国家市场监督管理总局发布2020年度药品审批报告(二)
二、药品注册申请受理情况
(一)总体情况
2020年,根据46号公告、《国家药监局关于发布生物制品注册分类及申报资料要求的通告》(2020年第43号)、《国家药监局关于发布化学药品注册分类及申报资料要求的通告》(2020年第44号)、《国家药监局关于发布<中药注册分类及申报资料要求>的通告》(2020年第68号)等,药审中心受理中药、化学药、生物制品各类注册申请共10245件(含药械组合产品6件),较2019年增长26.76%。其中,需技术审评的注册申请7147件(含5695件需药审中心技术审评和行政审批的注册申请),较2019年增长15.29%;直接行政审批的注册申请3092件,较2019年增长64.64%。
受理的10239件药品注册申请中,化学药注册申请受理量为7901件,较2019年增长22.02%,占2020年全部注册申请受理量的77.17%,2016-2020年各类药品注册申请受理情况详见图17。
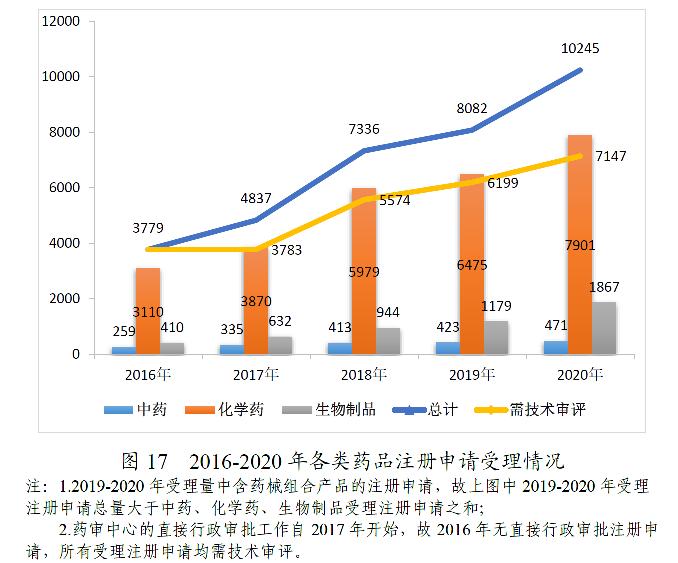
2.药审中心的直接行政审批工作自2017年开始,故2016年无直接行政审批注册申请,所有受理注册申请均需技术审评。
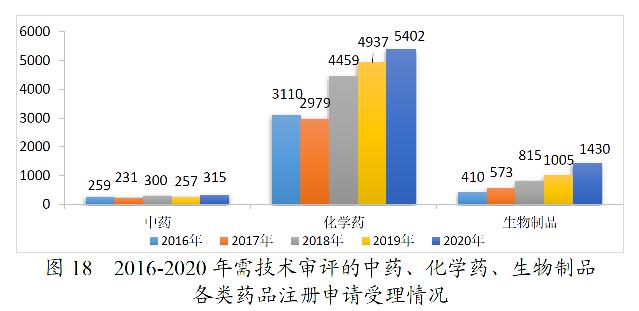
2020年受理的需技术审评的注册申请7147件中,化学药注册申请为5402件,较2019年增长9.42%,占全部需技术审评的注册申请受理量的75.58%;中药注册申请315件,较2019年增长22.57%;生物制品注册申请1430件,较2019年增长42.29%。2016-2020年需技术审评的中药、化学药、生物制品各类注册申请受理情况详见图18。
(二)1类创新药受理情况
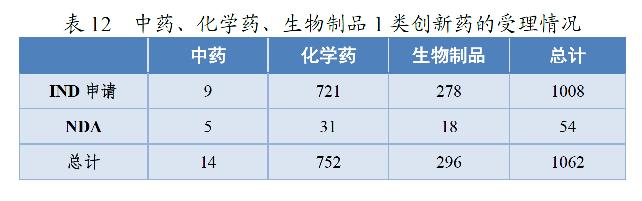
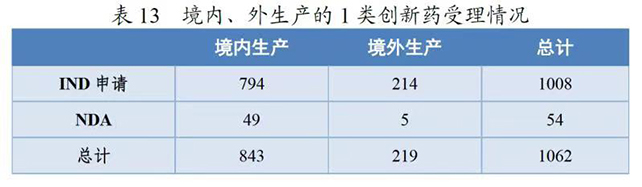
2020年,药审中心受理1类创新药注册申请共1062件(597个品种),较2019年增长51.71%。其中,受理IND申请1008件(559个品种),较2019年增长49.78%;受理NDA 54件(38个品种),较2019年增长100.00%。以药品类别统计,中药、化学药、生物制品1类创新药受理量分别为14、752、296件。以生产场地统计,境内生产药品843件,境外生产药品219件。详见表12和13。
(三)各类注册申请受理情况
1.中药注册申请受理情况
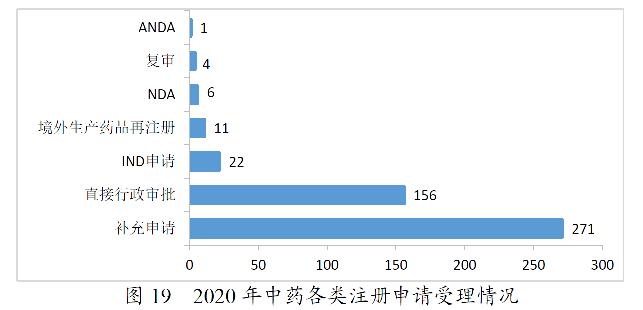
2020年,药审中心受理中药注册申请471件。其中,受理中药IND申请22件,受理中药NDA 6件,受理中药ANDA 1件。2020年中药各类注册申请受理情况详见图19。
受理1类中药创新药注册申请14件。其中,受理IND 申请9件(9个品种),受理NDA 5件(5个品种)。
2.化学药注册申请受理情况
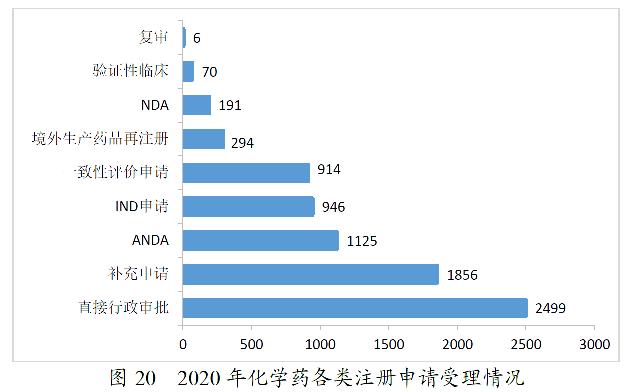
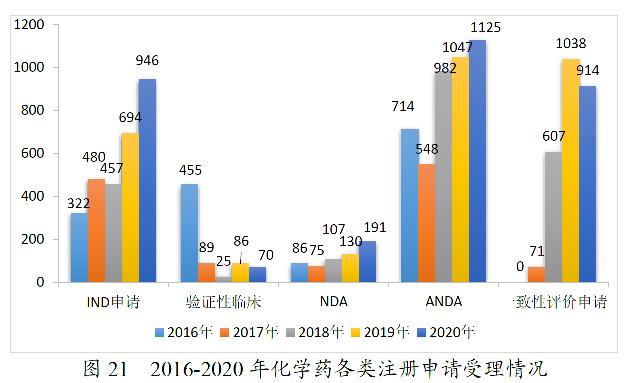
2020年,药审中心受理化学药注册申请7901。其中,受理化学药IND申请946件,较2019年增长36.31%;受理化学药NDA 191件,较2019年增长46.92%;受理ANDA 1125件,较2019年增长7.45%;受理一致性评价申请914件,较2019年减少11.95%。2020年化学药各类注册申请受理情况详见图20。2016-2020年化学药各类注册申请受理情况详见图21。
药审中心受理1类创新化学药注册申请752件(360个品种),较2019年增长31.24%。其中,受理IND申请721件(339个品种),较2019年增长30.62%;受理NDA 31件(21个品种),较2019年增长47.62%。
药审中心受理化学药5.1类注册申请160件,较2019年增长1.91%。其中受理临床试验申请(验证性临床)53件,受理NDA 107件。
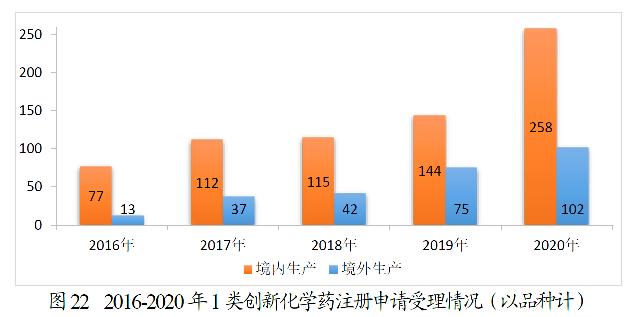
360个品种的1类创新化学药注册申请中,境内生产化学药注册申请为258个品种,境外生产化学药注册申请为102个品种。2016-2020年1类创新化学药注册申请受理情况详见图22。
3.生物制品注册申请受理情况
2020年,药审中心受理生物制品注册申请1867件。其中,受理生物制品IND申请580件(预防用IND申请25件,治疗用IND申请555件),较2019年增长87.10%;受理生物制品NDA 126件(预防用NDA 7件,治疗用NDA 117件,体外诊断试剂2件),较2019年增长1.62%。2020年生物制品各类注册申请受理情况详见图23。2016-2020年生物制品IND申请和NDA受理情况详见图24。
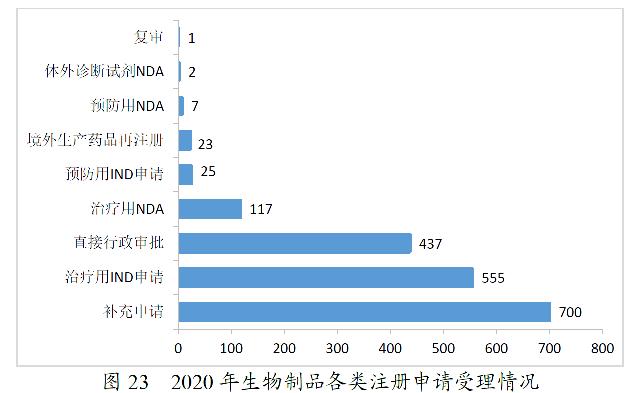
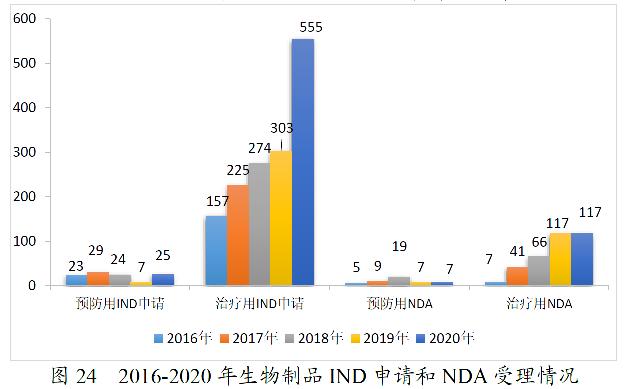
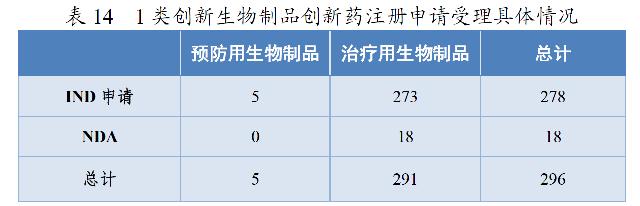
药审中心受理1类创新生物制品注册申请296件(223个品种),较2019年增长133.07%。其中,受理预防用生物制品5件,受理治疗用生物制品291件;受理生物制品IND申请278件(211个品种),较2019年增长129.75%;受理生物制品NDA 18件(12个品种),较2019年增长200.00%,具体情况详见表14。
4.行政审批注册申请受理情况
(1)总体情况
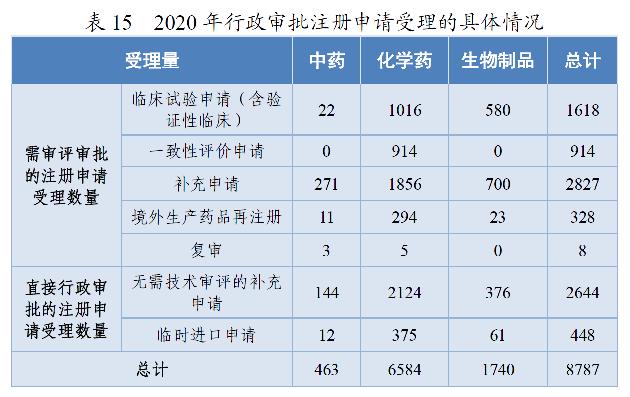
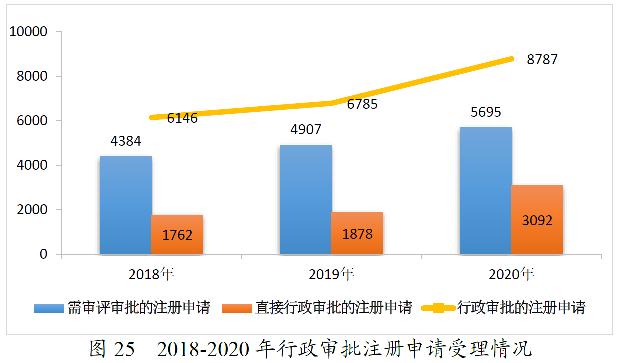
2020年,药审中心受理需中心行政审批的中药、化学药、生物制品各类注册申请8787件,较2019年增长29.51%。其中,受理需审评审批的注册申请(临床试验申请、一致性评价申请、补充申请、境外生产药品再注册及复审)5695件,较2019年增长16.06%;受理直接行政审批的注册申请(无需技术审评的补充申请、临时进口申请)3092件,较2019年增长64.64%。2020年行政审批注册申请受理的具体情况详见表15。2016-2020年行政审批注册申请受理情况详见图25。
(2)需审评审批的注册申请受理情况
药审中心受理5695件需审评审批的注册申请中,临床试验申请1618件(含验证性临床)、一致性评价申请914件、补充申请2827件、境外生产药品再注册328件、复审8件。
(3)直接行政审批的注册申请受理情况
药审中心受理3092件直接行政审批的注册申请中,按申请类型划分,补充申请2644件、临时进口申请448件。按药品类型划分,中药156件、化学药2499件、生物制品437件。
- 上一篇:国家市场监督管理总局发布2020年度药品审批报告(三) 2021/7/3
- 下一篇:国家市场监督管理总局发布2020年度药品审批报告(一) 2021/6/26



 豫公网安备 41019702002481号
豫公网安备 41019702002481号