国家市场监督管理总局发布2020年度药品审批报告(一)
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家药监局)的坚强领导下,认真学习贯彻习近平总书记重要讲话和重要指示批示精神,闻令而动、尽锐出战,坚持人民至上、生命至上,超常规建立“早期介入、持续跟踪、主动服务、研审联动”全天候应急审评审批工作机制,加速推动新冠病毒疫苗和新冠肺炎治疗药物研发上市,充分发挥技术审评对疫情防控的科技支撑作用;主动服务于药监系统工作大局,紧紧围绕落实党中央国务院审评审批制度改革、贯彻《药品管理法》《疫苗管理法》《药品注册管理办法》、推动审评体系和审评能力现代化,统筹推进疫情防控和依法依规科学审评工作,不断提高审评质量和效率,不断加快新药研发上市步伐,为疫情防控和满足临床急需提供有效药物保障、为医药产业高质量发展提供有力促进作用,保障了人民群众用药安全有效可及,药品审评事业得到新发展、迈上新台阶、开创新局面。
一、药品注册申请审评审批情况
(一)总体完成情况
1.全年审评审批完成情况
2020年,根据《药品注册管理办法》(国家市场监督管理总局令第27号)、《国家药监局关于实施<药品注册管理办法>有关事宜的公告》(2020年第46号,以下简称46号公告)及《药品注册管理办法》相关配套文件,药审中心完成中药(包括民族药,下同)、化学药、生物制品各类注册申请审评审批共11582件(含器械组合产品4件,以受理号计,下同),较2019年增长32.67%(如无说明,以注册申请件数计,下同)。其中,完成需技术审评的注册申请8606件(含5674件需药审中心技术审评和行政审批注册申请),较2019年增长26.24%;完成直接行政审批(无需技术审评,下同)的注册申请2972件。2020年底正在审评审批和等待审评审批的注册申请已由2015年9月高峰时的近22000件降至4882件(不含完成技术审评因申报资料缺陷等待申请人回复补充资料的注册申请)。
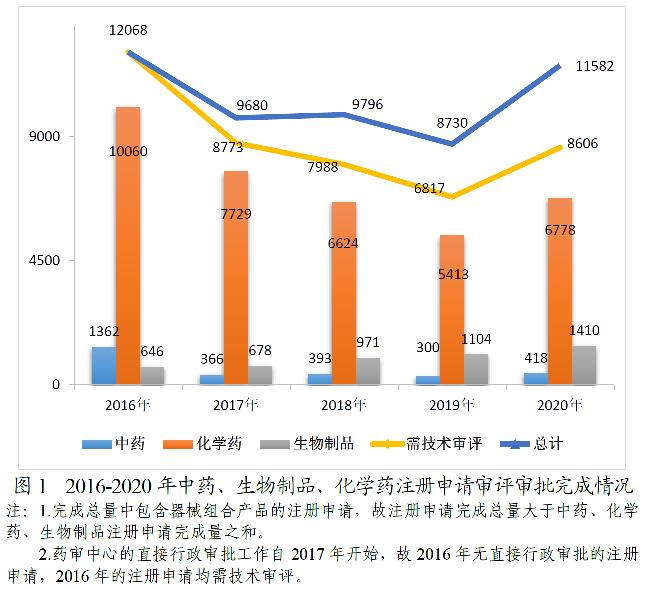
完成8606件需技术审评的药品注册申请中,化学药注册申请为6778件,较2019年增长25.22%;中药注册申请418件,较2019年增长39.33%;生物制品注册申请1410件,较2019年增长27.72%;化学药注册申请约占全部技术审评完成量的78.76%。2016-2020年中药、生物制品、化学药注册申请审评审批完成情况详见图1。
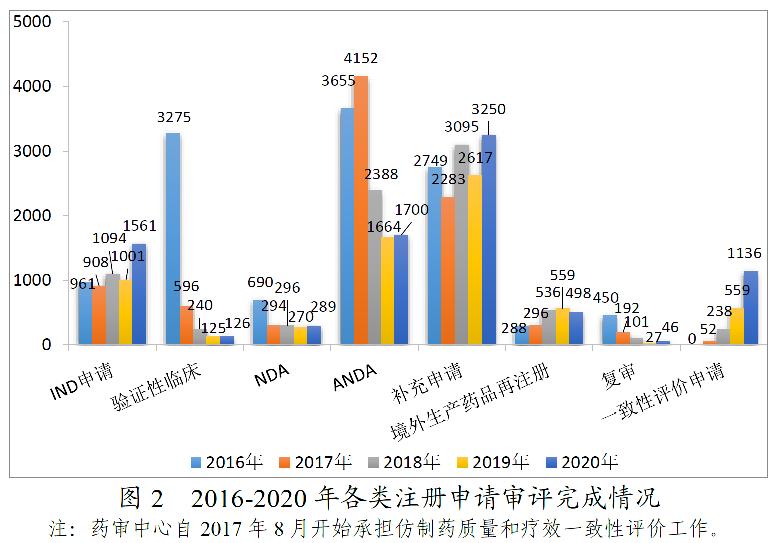
药审中心完成需技术审评的8606件注册申请中,完成新药临床试验(IND)申请审评1561件,较2019年增长55.94%;完成新药上市申请(NDA)审评289件,完成仿制药上市申请(ANDA)审评1700件;完成仿制药质量和疗效一致性评价(以下简称一致性评价)申请(以补充申请途径申报)1136件,较2019年增长103.22%;完成补充申请技术审评3250件,较2019年增长24.19%。2016-2020年各类注册申请审评完成情况详见图2。
3.审评通过情况
2020年,药审中心审评通过批准IND申请1435件,较2019年增长54.97%;审评通过NDA 208件,较2019年增长26.83%;审评通过ANDA 918件;审评通过批准一致性评价申请577件,较2019年增长121.92%。
药审中心审评通过创新药NDA 20个品种,审评通过境外生产原研药品NDA 72个品种(含新增适应症品种),具体品种详见附件1、2。
4.审结注册申请任务按时限完成情况
2020年,药审中心持续优化审评流程,严格审评时限管理,加强项目督导,加快审评速度,整体审评任务和重点序列审评任务按时限完成率均取得显著提升。全年审结注册申请任务整体按时限完成率为94.48%,其中临床急需境外已上市新药注册申请审结任务整体按时限完成率为100%,按默示许可受理注册申请的审结任务整体按时限完成率为99.87%,直接行政审批的注册申请100%在法定的20个工作日内完成,且审批平均用时11.8个工作日。各类注册申请任务按时限完成情况详见表1。
2020年的NDA年度整体按时限完成率已经有了很大的提升,例如:NDA按时限完成率在2020年12月突破80%,提升至87.5%;ANDA按时限完成率在2020年12月突破90%,达到93.85%;纳入优先审评程序的注册申请按时限完成率在2020年10-12月的月度按时限完成率连续达到90%以上,取得历史性突破。
(二)中药注册申请审评完成情况
1.总体情况
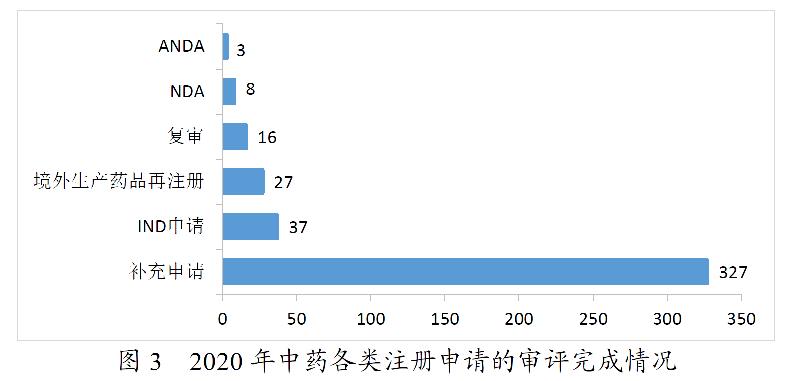
2020年,药审中心完成审评的中药注册申请418件。其中,完成IND申请37件,完成NDA 8件,完成ANDA 3件。2020年中药各类注册申请的审评完成情况详见图3。
2.审评通过情况
药审中心审评通过批准中药IND申请28件,审评通过中药NDA 4件(连花清咳片、筋骨止痛凝胶、桑枝总生物碱片及桑枝总生物碱)。2020年中药各类注册申请审评完成的具体情况详见表2,2016-2020年审评通过批准中药IND申请和审评通过中药NDA情况详见图4。
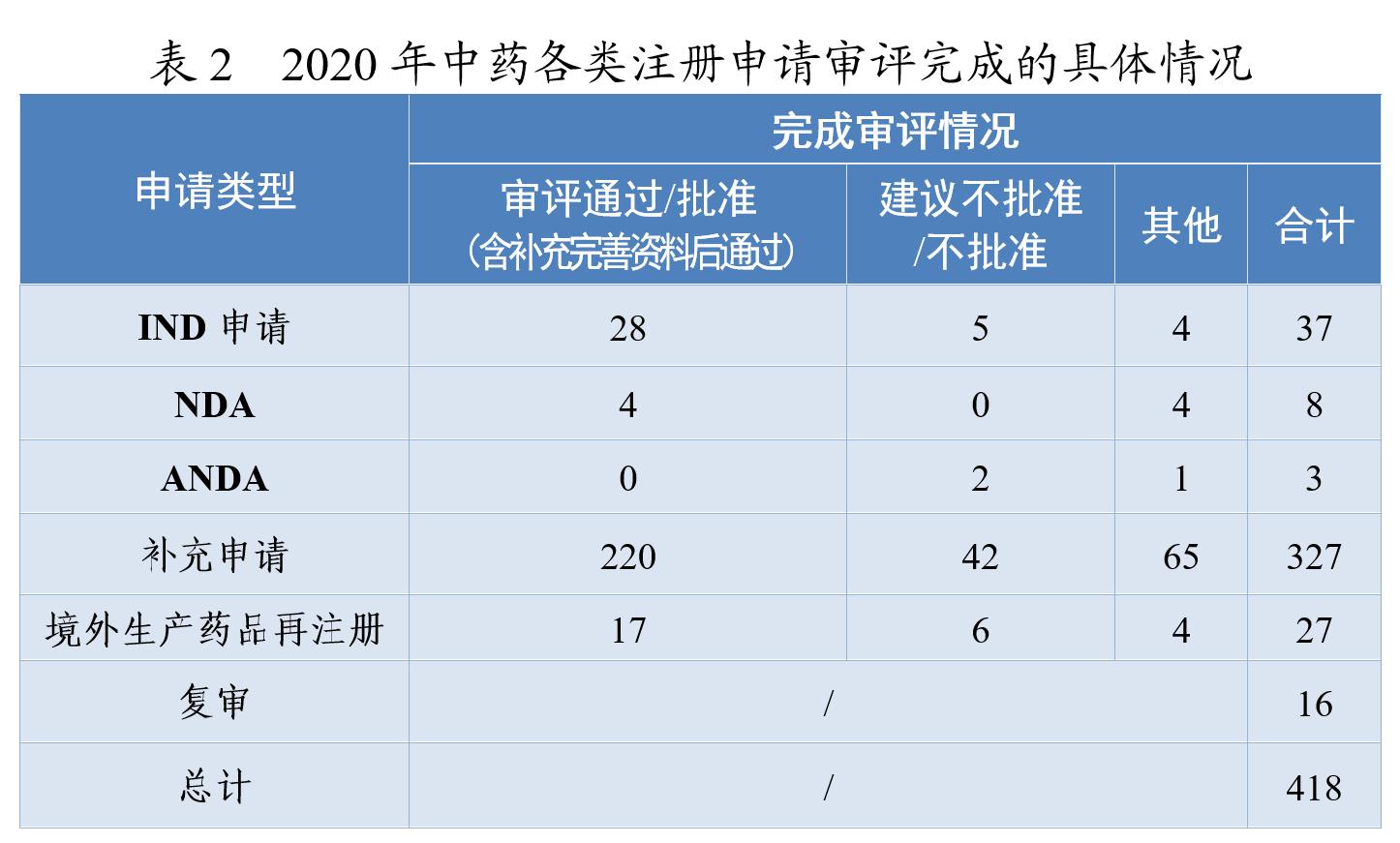
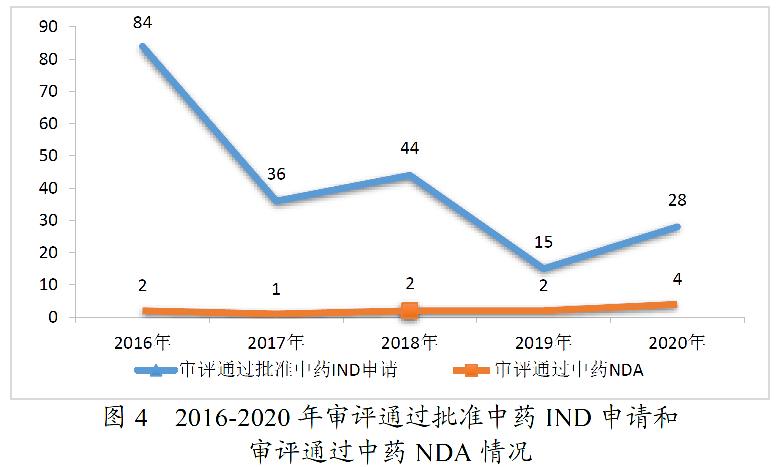
药审中心审评通过批准的中药IND申请28件,涉及10个适应症领域。其中,呼吸7件、骨科4件、消化4件,共占53.57%,2020年审评通过批准的中药IND申请适应症分布详见图5。
(三)化学药注册申请审评完成情况
1.总体情况
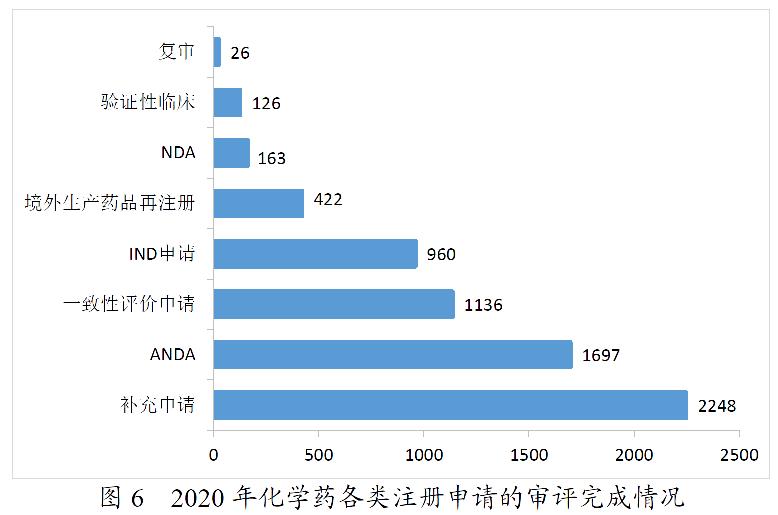
2020年,药审中心完成审评的化学药注册申请6778件。其中,完成化学药临床申请(IND申请和验证性临床)共1086件,较2019年增长45.58%;完成化学药NDA 163件;完成化学药ANDA 1697件;完成一致性评价申请1136件,较2019年增长103.22%;完成化学药补充申请2248件,较2019年增长23.72%。2020年化学药各类注册申请的审评完成情况详见图6。
2.审评通过情况
药审中心完成审评的化学药注册申请中,审评通过批准IND申请907件,较2019年增长51.42%;审评通过NDA 115件,较2019年增长30.68%;审评通过ANDA 918件,较2019年增长15.33%。2020年化学药各类注册申请审评完成的具体情况详见表3。
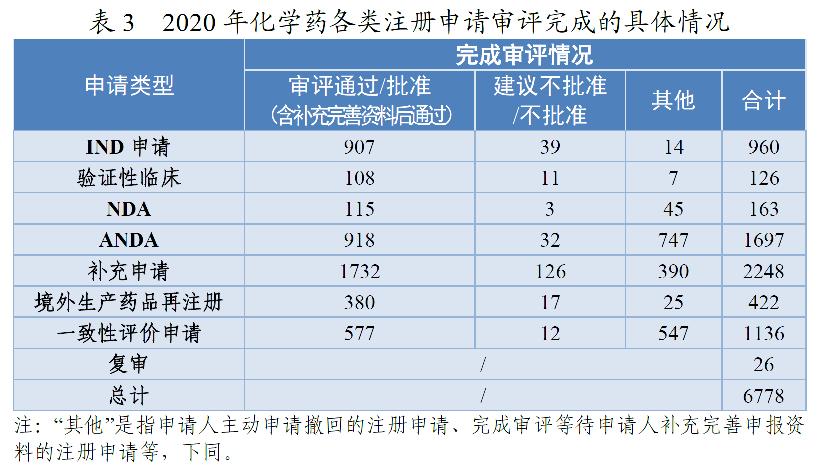
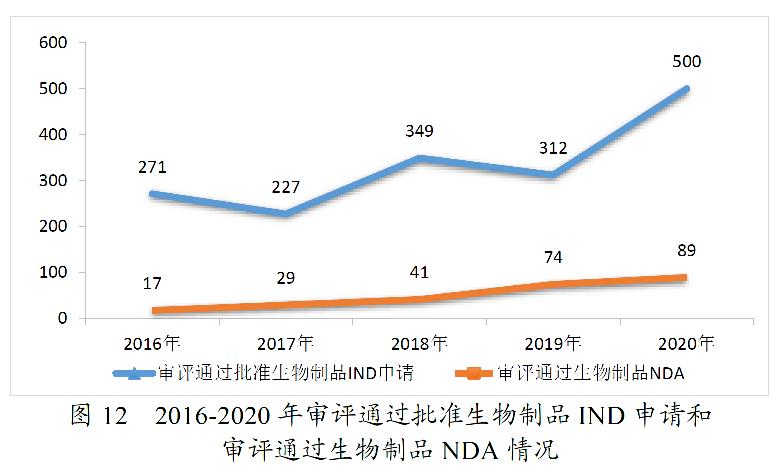
药审中心完成审评的化学药IND申请960件,审评通过批准IND申请907件。其中,1类创新化学药IND申请694件(298个品种),较2019年增长40.77%,品种数较2019年增长57.67%。2016-2020年审评通过批准化学药IND申请、1类创新化学药IND申请情况详见图7。
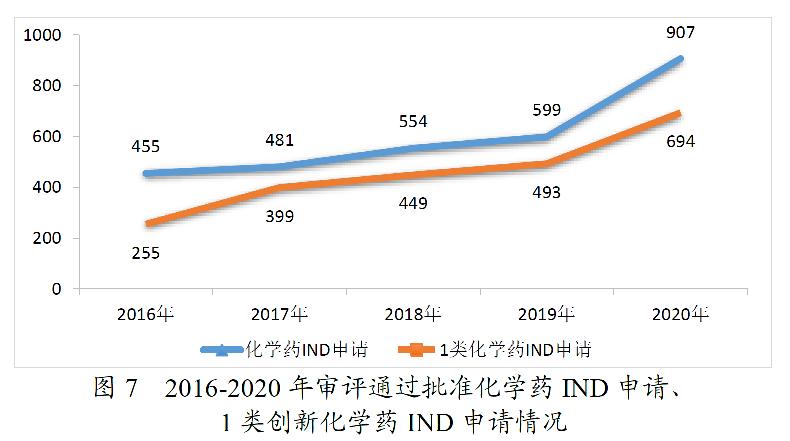
药审中心审评通过批准IND申请的694件1类创新化学药中,抗肿瘤药物、抗感染药物、循环系统疾病药物、内分泌系统药物、消化系统疾病药物和风湿性疾病及免疫药物较多,占全部创新药临床试验批准数量的80.69%。2020年审评通过批准的1类创新化学药IND申请适应症分布详见图8。
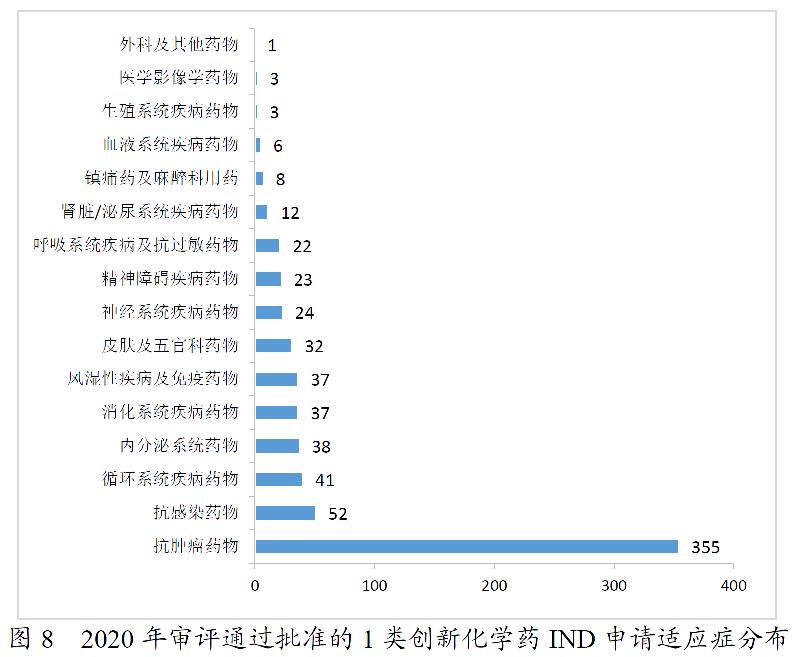
药审中心完成审评的化学药NDA共163件。其中,审评通过化药NDA 115件,审评通过1类创新化学药NDA 14个品种。2016-2020年审评通过化学药NDA情况详见图9。
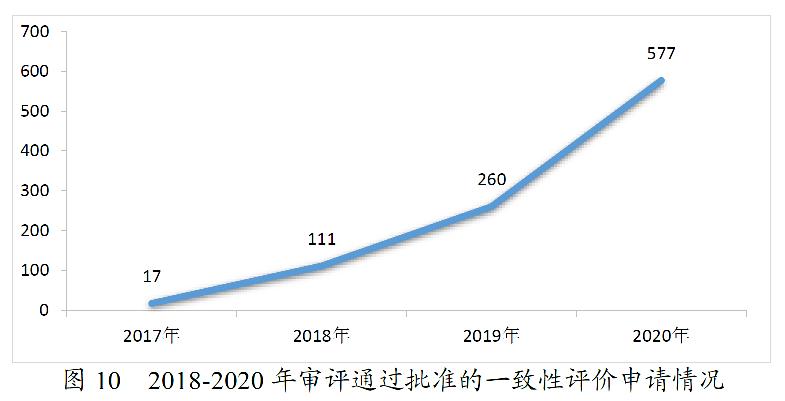
药审中心完成审评的一致性评价申请共1136件,审评通过577件。其中,审评通过批准口服固体制剂一致性评价456件,审评通过批准注射剂一致性评价申请121件,具体品种详见附件3。2018-2020年审评通过批准的一致性评价申请情况详见图10。
(四)生物制品注册申请审评完成情况
1.总体情况
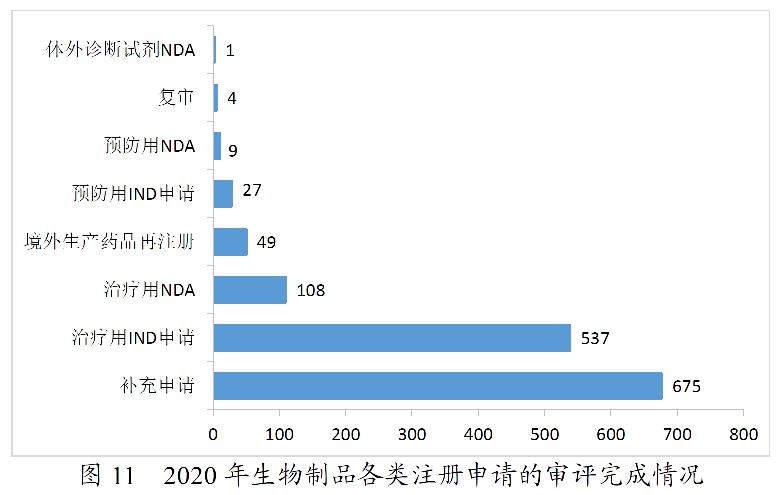
2020年,药审中心完成审评的生物制品注册申请共1410件。其中,完成预防用生物制品IND申请(预防用IND申请)27件,完成治疗用生物制品IND申请(治疗用IND申请)537件,较2019年增长58.88%;完成预防用生物制品NDA(预防用NDA)9件,完成治疗用生物制品NDA(治疗用NDA)108件,完成体外诊断试剂NDA(体外诊断NDA)1件。2020年生物制品各类注册申请的审评完成情况详见图11。
2.审评通过情况
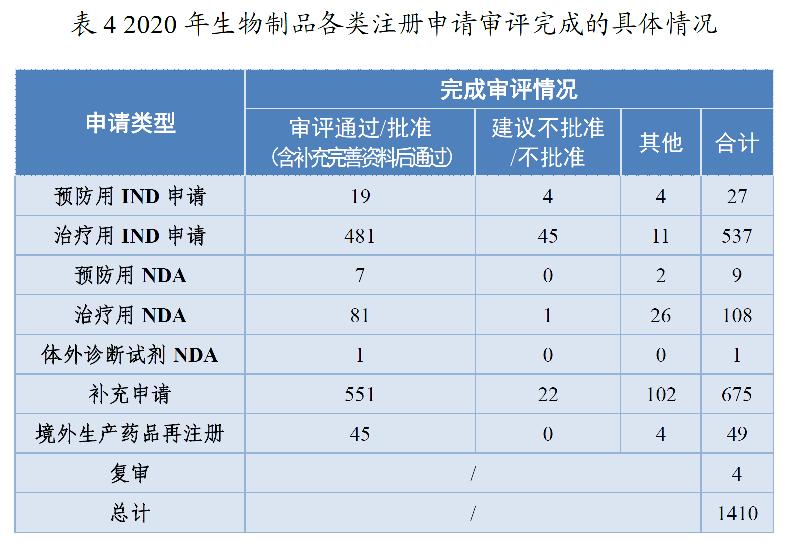
药审中心审评通过批准生物制品IND申请500件,较2019年增长60.26%。其中,预防用IND申请19件;治疗用IND申请481件,较2019年增长63.61%。审评通过生物制品NDA 89件,较2019年增长20.27%。其中,预防用NDA 7件;治疗用NDA 81件(制剂77件),较2019年增长19.12%;体外诊断NDA 1件。2020年生物制品各类注册申请审评完成的具体情况详见表4,2016-2020年审评通过批准生物制品IND申请和审评通过NDA情况详见图12。
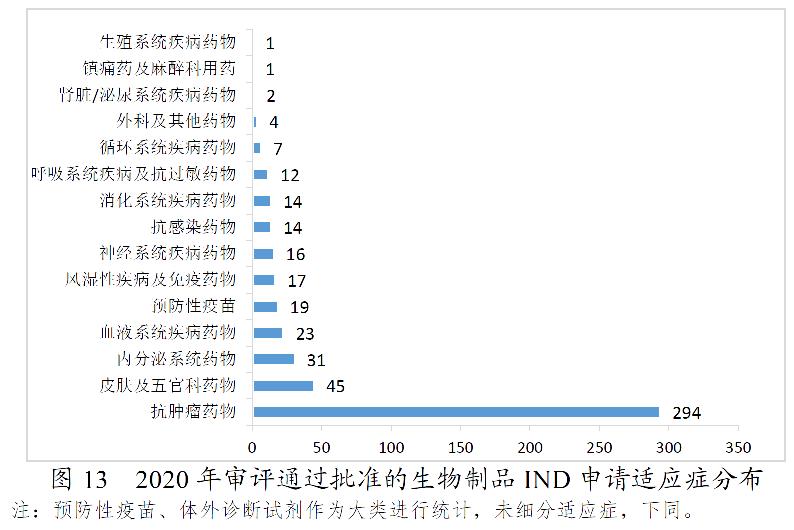
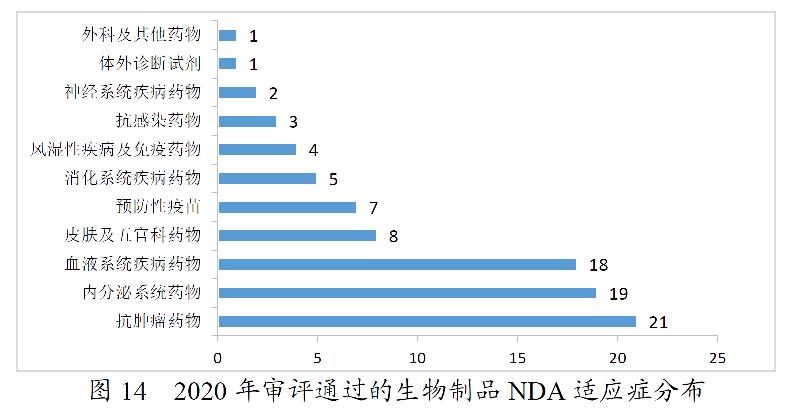
药审中心审评通过批准生物制品IND申请500件,2020年审评通过批准的生物制品IND申请适应症分布详见图13。药审中心审评通过生物制品NDA 89件,2020年审评通过的生物制品NDA适应症分布详见图14。
(五)行政审批注册申请完成情况
1.总体情况
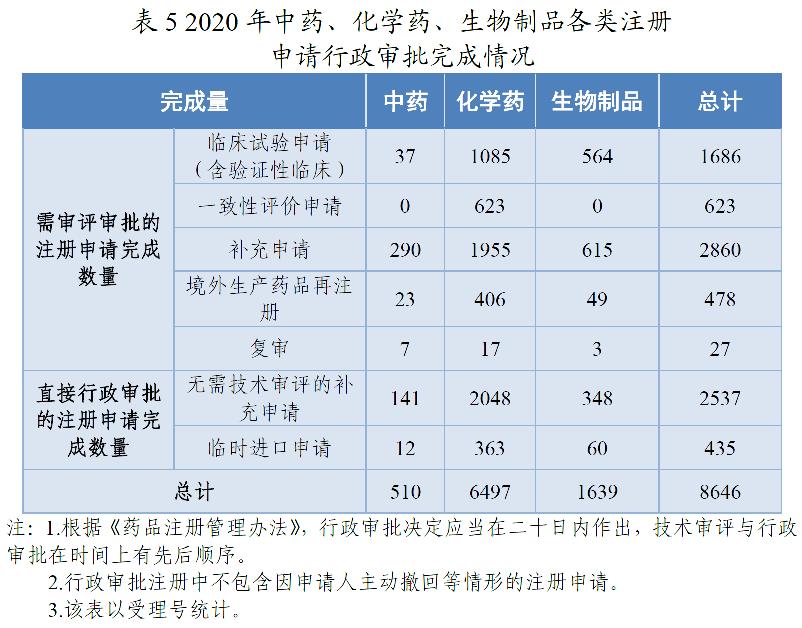
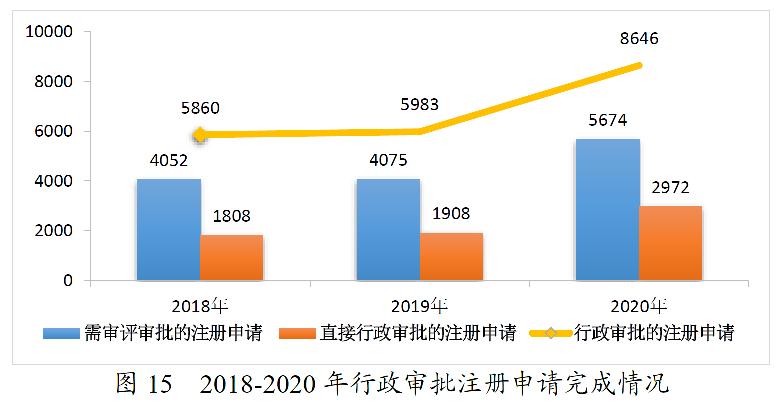
2020年,药审中心完成中药、化学药、生物制品各类注册申请行政审批共8646件,较2019年增长44.51%。其中,完成审评审批的注册申请(临床试验申请、一致性评价申请、补充申请、境外生产药品再注册及复审)5674件,较2019年增长39.24%;完成直接行政审批的注册申请(无需技术审评的补充申请、临时进口申请)2972件,较2019年增长55.77%。2020年中药、化学药、生物制品各类注册申请行政审批完成情况见表5。2018-2020年行政审批注册申请完成情况详见图15。
2.需审评审批的注册申请完成情况
药审中心完成的需审评审批的5674件注册申请中,临床试验申请1686件(含验证性临床),较2019年增长50.00%;一致性评价申请623件,较2019年增长80.58%;补充申请2860件,较2019年增长34.46%;境外生产药品再注册478件、复审27件。
3.直接行政审批的注册申请完成情况
药审中心完成直接行政审批的2972件注册申请中,按注册申请类型划分,补充申请2537件、临时进口申请435件。按药品类型划分,中药153件、化学药2411件、生物制品408件。
(六)注册申请不批准的主要原因及存在的问题
2020年,中药、化学药、生物制品各类药品注册申请因申报资料无法证明药品安全性、有效性或者质量可控性,以及未能按期提交补充资料等情形,导致审评结论为建议不批准的共367件。通过系统梳理上述注册申请不批准原因,从新药、仿制药等不同注册分类角度分析药品注册申请在研发和申报过程中存在的主要问题包括:
1.新药申请
IND申请和研发中存在的问题主要有:正式申报前未开展沟通交流;开发立题依据不足,成药性存在严重缺陷;申报资料不足以支持开展药物临床试验或者不能保障临床受试者安全。具体表现包括:未沟通交流致使申报后发现研究信息严重缺项,无法在时限内完成补充研究;已有的研究结果提示药效作用弱,毒性大,临床获益和风险比值不合理;临床开发定位违背临床诊疗、用药的基本原则;已有的药学、临床前研究不符合临床试验要求;临床试验方案整体设计严重缺陷,风险控制措施不足;联合用药的非临床研究数据不充分;联合疫苗中单苗的数据不充分和/或免疫程序不一致。
NDA研发和申报中存在的问题主要有:研究质量控制和管理存在缺陷,导致已有的研究结果不能证明药品安全性、有效性和质量可控性;违反合规性要求。具体表现包括:关键临床研究设计存在重大缺陷,无法得出客观、有力的有效性、安全性证据;药学研究存在严重缺陷,无法证明产品的质量可控性;各开发阶段的研究受试样品不一致;注册核查中发现临床试验数据存在真实性问题。
2.仿制药申请
仿制药一致性评价申请和上市申请中存在的问题主要有:仿制药研发立题不合理;申报资料无法证明仿制药与参比制剂(被仿制药品)的质量一致性。具体表现包括:仿制药的参比制剂已撤市,且已有更新换代安全性更好的产品满足临床需求;样品复核检验不符合规定或分析方法存在严重缺陷;人体生物等效性试验结果表明不等效;样品稳定性研究结果、原料药起始物料选择等不符合仿制药上市技术要求;仿制药未按规定使用具有合法来源的原料药。
3.补充申请
补充申请研究和申报中存在的问题主要有:申请资料未能充分说明变更的科学性和合理性,不足以支持变更事项;已有的研究结果不能保证变更后产品的安全性、有效性和质量可控性。具体表现包括:变更引起药用物质基础发生重大改变;药品说明书修改申请不符合说明书撰写的技术要求;用于支持变更的文献资料存在偏倚,或者临床安全性和有效性数据不充分。
4.其他
其他药品注册申请在研发和申报中存在的问题主要有:生物类似药开发缺少相似性比较数据,药学比对研究中参照药选择存在缺陷;生物类似药临床前研究结果不足以支持其开展临床试验;天然药物的研究资料不符合国际多中心临床试验或我国天然药物评价基本技术要求。
(七)药品加快上市注册程序情况
创新是推动药品高质量发展的力量源泉,《药品注册管理办法》结合我国医药产业发展和临床需求实际,参考国际经验,设立了特别审批、突破性治疗药物、附条件批准、优先审评审批四个药品加快上市程序。《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号),明确了加快通道的适用范围、适用条件、工作程序和政策支持等,既能显著提高相关程序执行过程中的可操作性,鼓励药物研制和创新,又能在全球抗击疫情的大背景下,依法依规对疫情防控所需药物实行特别审批,对于加快临床急需、临床价值突出、公共卫生急需等药物的上市具有重要推动作用。2020年已批准上市药品纳入加快上市程序情况详见附件4。
1.特别审批药物情况
在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,国家药监局可依法决定对突发公共卫生事件应急所需防治药品实行特别审批。纳入实施特别审批程序的药物,国家药监局按照统一指挥、早期介入、快速高效、科学审批的原则,组织加快并同步开展药品注册受理、审评、核查、检验工作,并根据疾病防控的特定需要,限定其在一定的期限和范围内使用。
2020年新冠肺炎疫情在全球范围内不断蔓延,人民群众的生命安全受到严重威胁,药审中心闻令而动,第一时间科学、高效推进特别审评工作,按程序将59件中药、化学药、生物制品注册申请纳入特别审批程序并完成技术审评。建议附条件批准上市1件,为新型冠状病毒灭活疫苗(Vero细胞);建议批准临床试验申请53件,其中5件已进入Ⅲ期临床试验,批准化湿败毒颗粒、清肺排毒颗粒的临床试验申请;批准了连花清瘟胶囊/颗粒、金花清感颗粒及血必净注射液等5件增加适应症的补充申请,加速了新冠病毒疫苗和新冠肺炎治疗药物的上市进程,初步满足了新冠肺炎疫情防控的需要。
2.突破性治疗药物情况
突破性治疗药物指的是用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可在Ⅰ、Ⅱ临床试验阶段申请适用突破性治疗药物程序。根据《突破性治疗药物审评工作程序(试行)》,纳入到“突破性治疗”审评通道的药物,药审中心一是会优先处理相关沟通交流,加强指导并促进药物研发进程;二是在申报上市环节,该药物可适用优先审评审批程序,审评时限进一步缩短;三是上市申请阶段,药审中心会滚动接收其申报资料,并优先安排核查、检验等,可大大缩减新药从研发到上市的时间。2020年药审中心收到147件突破性治疗药物申请。经综合评估、公示,已将24件突破性治疗药物申请(21个品种)纳入突破性治疗药物程序,详见附件5。
3.附条件批准药物情况
附条件批准上市,目的在于缩短药物临床试验的研发时间,使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。药物有效性评价的指标为临床终点,符合附条件批准上市情形的药物,可使用替代终点、中间临床终点或早期临床试验数据来反映药物的有效性,当这些数据能够提示药品的获益大于风险时候,即可申请附条件批准上市。
对于若不尽早进行治疗则会在数月或者更短时间内导致死亡的疾病患者来说,附条件批准上市的药物,使得这些无法继续等待的患者能够延续生命、提高生存质量,消除重大突发公共卫生事件对于人民生命安全的威胁。2020年药审中心审评通过的新药上市申请中,共有15件注册申请经附条件批准后上市,覆盖了新型冠状病毒感染引起的疾病、非小细胞肺癌、卵巢癌等适应症。
4.优先审评药物情况
(1)优先审评品种纳入情况
《药品注册管理办法》对优先审评审批程序的调整,是在多年实践经验基础上的优化,一是适用范围更多地向具有明显临床价值、临床急需和临床优势的药物聚焦,致力于将更多的临床价值显著、临床急需的短缺药品、防治重大传染病、罕见病、儿童用药、纳入突破性治疗程序、符合附条件批准的药品等纳入优先审评程序;二是审评时限的加速,药品上市许可申请的审评时限一般为200个工作日,与完整的申报路径相比,优先审评审批程序的审评时限缩短至130个工作日,其中临床急需境外已上市罕见病用药优先审评审批程序的审评时限为70个工作日。药审中心通过优化审评资源配置率,在高标准完成技术审评的前提下,力争按时限完成审评,推动纳入优先审评审批程序中的品种尽快获批上市。
根据《药品注册管理办法》、46号公告、《国家食品药品监督管理总局关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号,以下简称126号文件),2020年药审中心将219件(按通用名计127个品种)注册申请纳入优先审评审批程序。其中,144件注册申请按照126号文件规定的范围纳入优先审评审批程序,75件按照《药品注册管理办法》规定的范围纳入优先审评审批程序,包括42件儿童用药和罕见病用药。2016-2020年纳入优先审评审批程序的各类注册申请情况详见表6和表7。
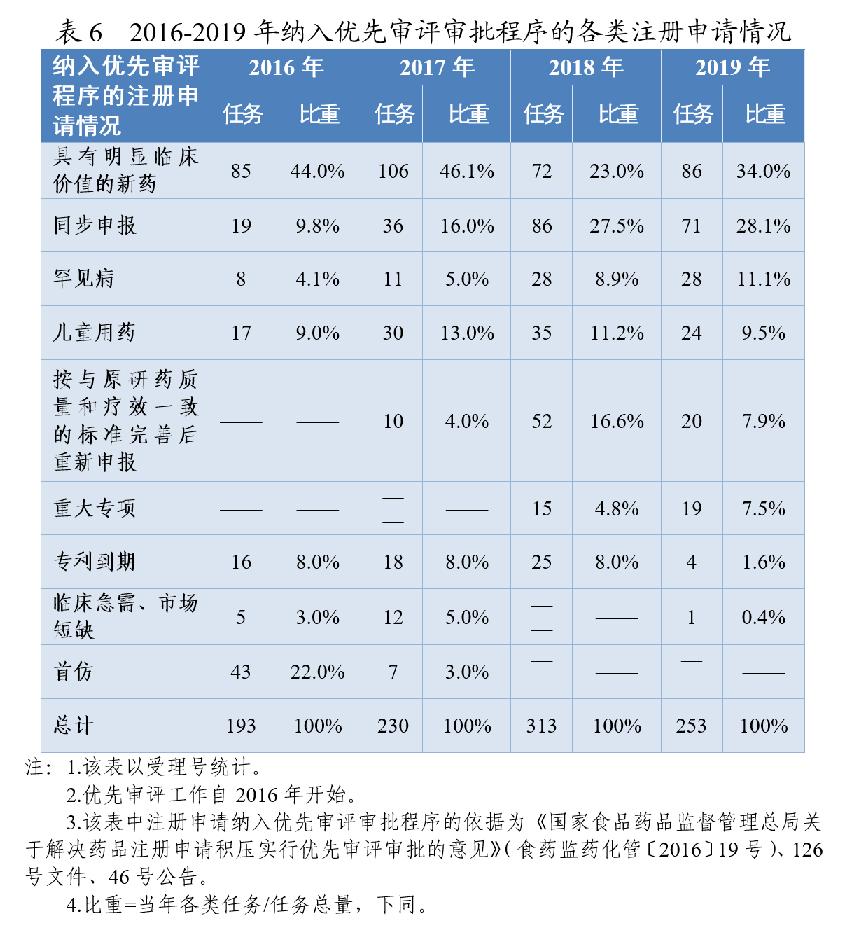
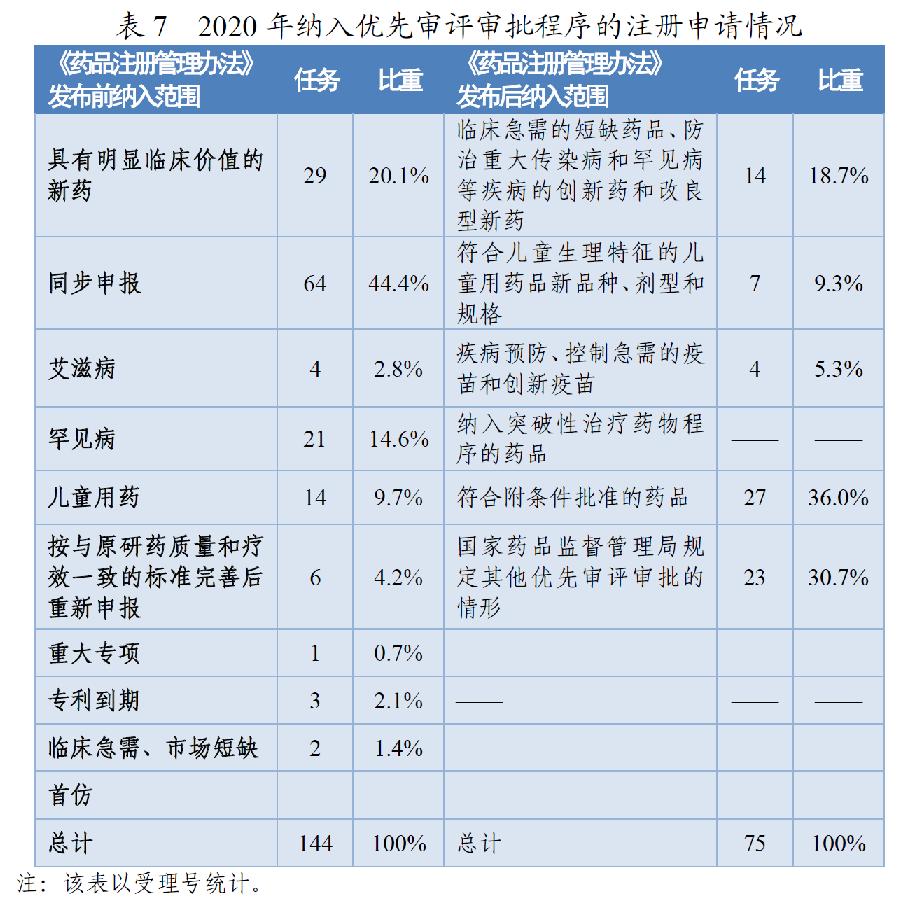
按此前优先审评范围纳入的注册申请中,同步申报占比多达44%(64/144),具有明显临床价值的新药占比为20%,按与原研药质量和疗效一致的标准完善后重新申报品种占比则由7.9%降至4.2%。
按照《药品注册管理办法》优先审评范围纳入的注册申请中,符合附条件批准的药品占比为36%(27/75),创新药和儿童用药占比28%(21/75),优先审评资源已向具有明显临床价值的创新、急需药物倾斜。
(2)优先审评品种完成情况
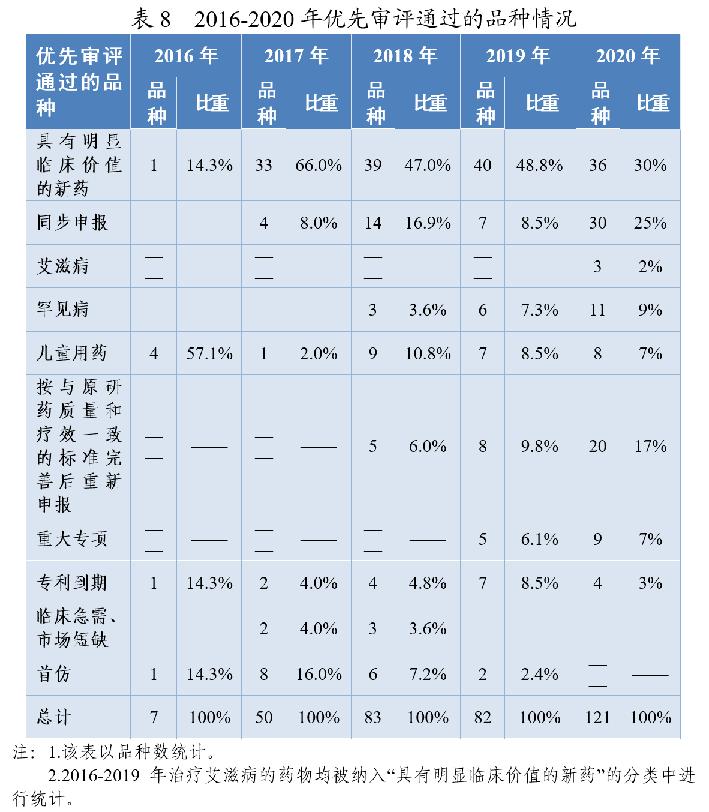
2020年有217件注册申请(按通用名计121个品种)通过优先审评程序建议批准上市(含已上市药品新增适应症),审评通过件数较2019年增长51.7%,例如:我国自主研发的1类创新药甲磺酸阿美替尼片、泽布替尼胶囊、奥布替尼片等,治疗罕见病法布雷病阿加糖酶α注射用浓溶液,用于配合饮食控制及运动治疗2型糖尿病的中药新药桑枝总生物碱片、间变性淋巴瘤激酶抑制剂盐酸恩沙替尼胶囊、成人复发型多发性硬化治疗药物西尼莫德片等。2016-2020年优先审评通过的品种情况详见表8。
(八)药品注册现场核查相关情况
1.总体情况
药审中心积极落实《药品注册管理办法》,转变药品注册核查理念,将注册现场核查启动工作模式由基于审评需要调整为基于风险启动,并联开展技术审评与注册现场核查工作;对于自2020年7月1日起受理的注册申请,在受理后40个工作日内决定是否启动相应注册现场核查任务。为便于申请人及时获知注册现场核查启动相关信息,完善药审中心网站申请人之窗栏目,开通递交注册现场核查用生产工艺与质量标准通道和查收注册现场核查电子通知函的功能。
2.注册现场核查具体情况
2020年,药审中心基于品种因素和研发生产主体合规因素风险启动注册现场核查任务1235个。其中,药学现场核查任务792个,临床试验数据核查任务439个,药理毒理研究核查任务4个。
药审中心接收核查报告818份。其中,药学现场核查报告449份,临床试验核查报告363份,药理毒理研究核查报告6份。
(九)沟通交流情况
1.总体情况
2020年,药审中心在落实疫情防控要求的同时,尽量满足申请人的需要,全力保障各类沟通交流畅通。在推动新冠病毒疫苗和新冠肺炎治疗药物的研发方面,为79个新冠病毒疫苗,中医药、中和抗体(27个)等新冠肺炎治疗药物,组织申请人与药审中心审评团队之间的沟通交流5600余次,并针对新冠病毒疫苗、中和抗体等重点品种,单独设立了台账,动态跟进;在维护与申请人沟通桥梁方面,药审中心发布了《药物研发与技术审评沟通交流管理办法》《药审中心关于业务咨询服务联络方式的通知》,优化了电话咨询服务,每天有专人接听解答申请人咨询电话,根据咨询问题类型的不同设立了8个联系邮箱,及时解答处理申请人问题,不断提高沟通交流的质量和效率。
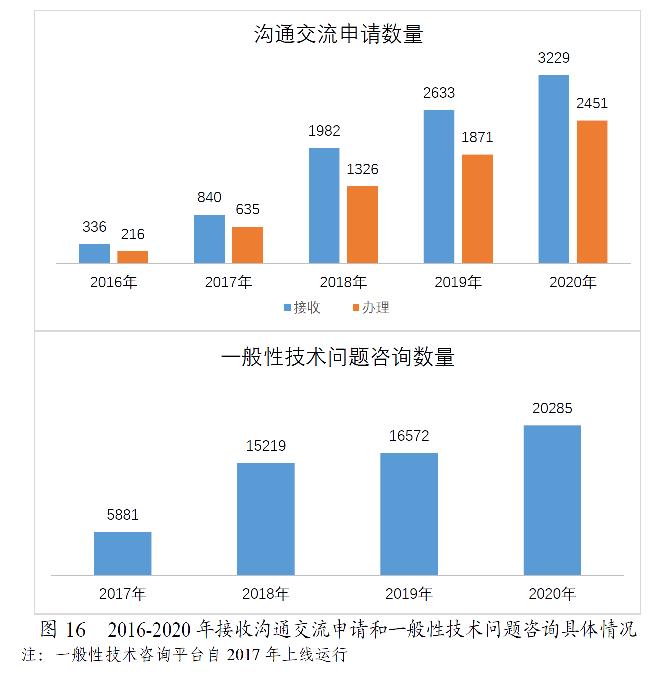
药审中心接收沟通交流会议申请3229件,较2019年增长22.64%,办理沟通交流会议申请2451件,较2019年增长31.00%。在网络平台接收一般性技术问题咨询20285个,较2019年增长22.41%;接收电话咨询超过上万次,邮件咨询数千件,同时也面向社会提供现场咨询服务。2016-2020年接收沟通交流申请和一般性技术问题咨询具体情况详见图16。
2.沟通交流会议申请的完成情况
药审中心所接收的3229件沟通交流会议申请中,符合会议召开条件的,及时与申请人取得了联系,商议会议细节;无需召开会议的,以书面形式尽快回复了申请人。2020年共办理了2451件沟通交流会议申请。在药物研发关键阶段召开的Ⅱ类会议占比76.42%,其中临床前(Pre-IND)申请占比37.49%。2020年各类沟通交流会议申请及办理情况详见表9。
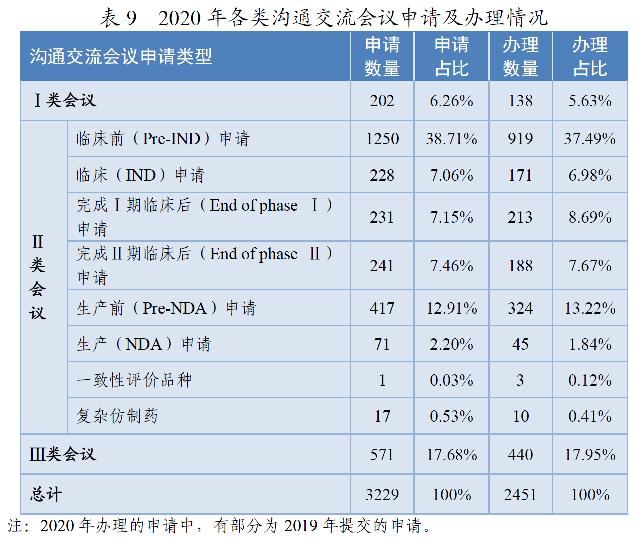
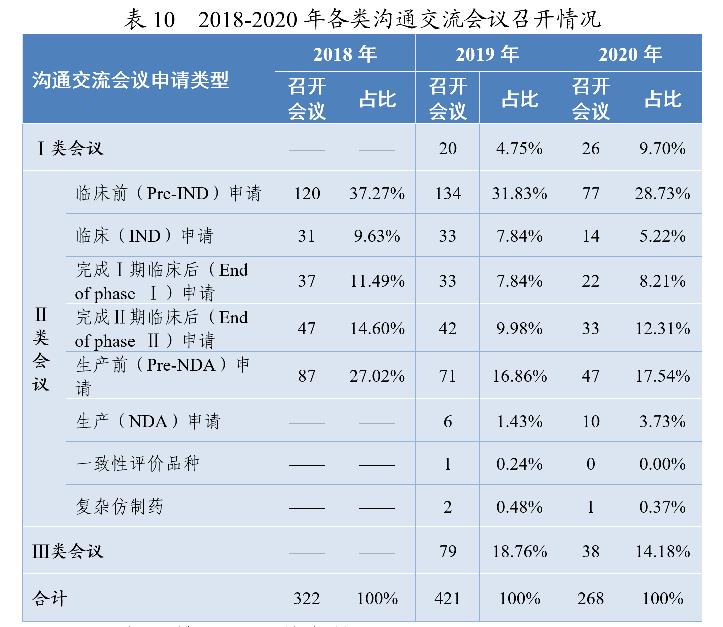
沟通交流会议的形式为电话会议、视频会议、面对面会议,共召开沟通交流会议268次,以书面形式回复两千余件。2018-2020年各类沟通交流会议的召开情况详见表10。
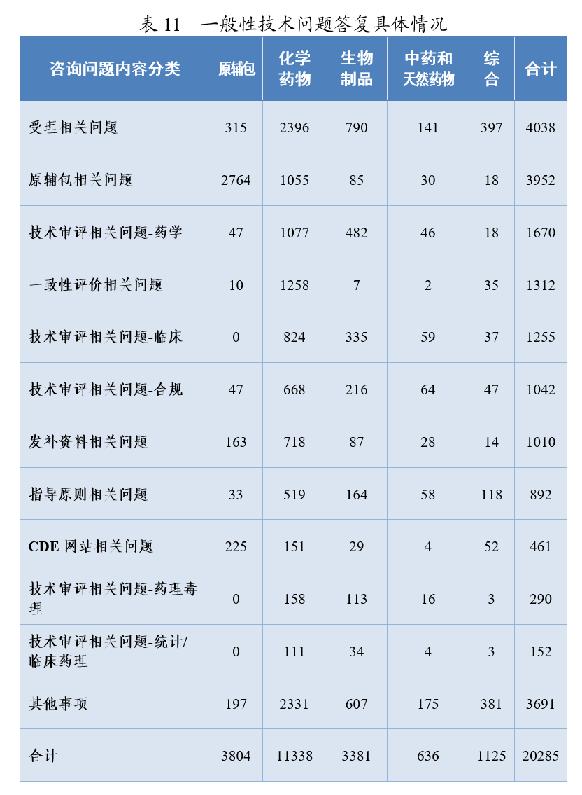
3.一般性技术问题答复情况
药审中心通过网上咨询平台共接收了20285个一般性技术问题的咨询。按照内容分类,问题主要集中于受理(4038个)、原辅包(3952个)等方面;按照药品分类,问题主要集中于化学药(11338个)方面,其中化学药受理(2396个)、化学药一致性评价(1258个)。一般性技术问题答复具体情况详见表11。
- 上一篇:国家市场监督管理总局发布2020年度药品审批报告(二) 2021/7/1
- 下一篇:中药大全-补虚-何首乌 2021/6/19



 豫公网安备 41019702002481号
豫公网安备 41019702002481号